مفهوم الأيون المشترك و مبدأ لوتشاتوليهCH3COOH  CH3COO- + H+
CH3COO- + H+
CH3COONa  CH3COO- + Na+
CH3COO- + Na+
ما الأيون الذي لأحظت وجوده في التفاعلين السابقين ؟
ما الأيون الذي لأحظت وجوده في التفاعلين السابقين ؟
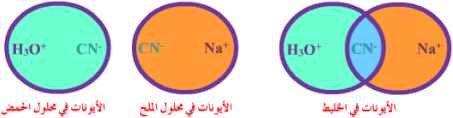
HCN  H+ + CN-
H+ + CN-
KCN K+ + CN-
K+ + CN-
KCN
ما الأيون الذي لأحظت وجوده في التفاعلين السابقين؟
في المثال الأول نلاحظ وجود الأيون -CH3COO في التفاعلين , فهو أيون مشترك .
في المثال الثاني نلاحظ وجود الأيون -CN في التفاعلين , فهو أيون مشترك .
و هذا يوضح مفهوم الأيون المشترك
لنفترض لدينا وعاء يحتوي ماء مقطر أضفنا إليه حمض الخليك CH3COOH و بالتالي يتأين الحمض حتى الوصول إلى حالة الإتزان وفقا ً للتفاعل :
في المثال الثاني نلاحظ وجود الأيون -CN في التفاعلين , فهو أيون مشترك .
و هذا يوضح مفهوم الأيون المشترك
لنفترض لدينا وعاء يحتوي ماء مقطر أضفنا إليه حمض الخليك CH3COOH و بالتالي يتأين الحمض حتى الوصول إلى حالة الإتزان وفقا ً للتفاعل :
لو أضفنا إلى هذا المحلول ملح CH3COONa الذي سيتأين في المحلول و فقا ً للتفاعل :
و بالتالي فإنّ الأيون المشترك -CH3COO سيزداد تركيزه في المحلول المتزن و سيختل وضع التوازن بين تركيز الأيونين +CH3COO- + Na في المحلول .
و لنعيد هذا المحلول إلى وضع الإتزان يجب أن نتذكر مبدأ لوتشاتولييه
مبدأ لوتشاتولييه :
إذا أثر مؤثر ما ( التركيز أوالضغط أودرجة الحرارة ) على تفاعل في حالة الاتزان فإن التفاعل يسير في الاتجاه الذي يقلل فيه من فعل هذا المؤثر.
و الملاحظ هنا أنّ المؤثر هو زيادة تركيز -CH3COO بسبب إضافة CH3COONa
فما المسار الذي سيسلكه التفاعل للتقليل من أثر هذه الزيادة و العودة لحالة الإتزان ؟
CH3COOH  CH3COO- + H+
CH3COO- + H+
بالتأكيد ستزداد سرعة التفاعل العكسي للتقليل من تركيز الأيون المشترك -CH3COO مما يقلل من تركيز أيونات الهيدروجين ( أيونات الهيدرونيوم ) .
و لكن ما أثر نقص تركيز+H على ال PH ؟
بالتاكيد فإنّ حموضة المحلول تقل و بالتالي تزداد قيمة ال PH .
و لكن ما أثر نقص تركيز+H على ال PH ؟
بالتاكيد فإنّ حموضة المحلول تقل و بالتالي تزداد قيمة ال PH .
تدريب :
ما الذي يحدث لقيمة PH محلول HCN عند إضافة الملح KCN إليه ؟
ليست هناك تعليقات:
إرسال تعليق